Test rapido antigene SARS-CoV-2, Influenza A e Influenza B (oro colloidale)
UTILIZZO PREVISTO
Questo kit consiste in una immunocromatografia con oro colloidale destinata al rilevamento qualitativo e alla differenziazione simultanea degli antigeni della proteina nucleocapside da virus SARS-CoV-2, influenza A e influenza B in campioni prelevati tramite tampone nasale umano diretto. Segnali e sintomi clinici dell'infezione virale respiratoria causata da SARS-CoV-2 e dall'influenza possono essere simili. Questo kit è adatto per il rilevamento di casi sospetti di infezione da SARS-CoV-2, influenza A e B, sintomatici o asintomatici, per lo screening dei pazienti in cluster sospetti o per altri soggetti che necessitano di diagnosi relativa a infezione da SARS-CoV-2, influenza A e influenza B. Bambini e adolescenti di età inferiore a 18 anni o persone che non sono in grado di capire correttamente le istruzioni dovrebbero effettuare il test sotto la supervisione di un adulto o di qualcuno in grado di comprendere correttamente le istruzioni.
RIEPILOGO
I nuovi coronavirus appartengono al genere β. La SARS-CoV-2 è una malattia infettiva respiratoria acuta. Le persone sono generalmente sensibili all’infezione. Attualmente, i pazienti contagiati dal nuovo coronavirus sono la principale fonte di infezione; anche le persone infette asintomatiche possono costituire una fonte di infezione. Sulla base dell'attuale indagine epidemiologica, il periodo di incubazione è compreso fra 1 e 14 giorni, principalmente da 3 a 7 giorni. Le manifestazioni principali includono febbre, affaticamento e tosse secca. In alcuni casi si riscontrano congestione nasale, rinorrea, mal di gola, mialgia e diarrea. L'infezione da influenza (comunemente nota come "influenza") è un'infezione virale acuta accompagnata da febbre, che porta principalmente a una malattia delle vie respiratorie e si manifesta come epidemia o pandemia. L'infezione si trasmette principalmente tramite goccioline (droplet). Il virus si diffonde dalle mucose delle vie respiratorie superiori all'intero tratto bronchiale. Lì il virus e la sua tossina possono causare una grave infiammazione della mucosa bronchiale e un danno vascolare. La distinzione dei tipi è resa possibile dalla diversa antigenicità delle loro nucleoproteine, che sono rivestite da una matrice proteica con antigenicità specifica per il tipo. L'influenza A porta spesso a un decorso clinico grave e a una diffusione epidemica del virus. Allo stesso modo, durante un'epidemia di influenza A, l'importanza epidemiologica e le misure per la protezione dell'individuo e della popolazione che ne scaturiscono sono fondamentalmente in primo piano insieme alla gravità dei sintomi clinici. L'influenza B spesso porta a brividi e febbre. La temperatura corporea sale a 39-40°C in un tempo che va da poche ore a 24 ore. Nell'uomo, i virus dell'influenza B evolvono più lentamente rispetto ai virus A e più velocemente rispetto ai virus C. Il virus dell'influenza B muta a una velocità da 2 a 3 volte inferiore rispetto al tipo A. Tuttavia, la mutazione dell'influenza B è sufficiente da rendere impossibile un'immunità duratura. Non può causare una diffusione epidemica del virus.
PRINCIPIO SU CUI SI BASA IL TEST
Il test consiste in un immunodosaggio con la tecnica del doppio anticorpo sandwich. Se nel campione sono presenti antigeni dei virus SARS-CoV-2, Influenza A e Influenza B, verranno combinati con anticorpo monoclonale di topo anti-SARS-CoV-2, anticorpo monoclonale di topo anti-influenza A, anticorpo monoclonale di topo anti-influenza B, marcati con oro colloidale, per formare un complesso. Sotto l'azione della cromatografia, il complesso scorre sulla membrana di nitrocellulosa. Quindi, il complesso verrà combinato con un altro anticorpo monoclonale di topo anti-SARS-CoV-2, anticorpo monoclonale di topo anti-influenza A, anticorpo monoclonale di topo anti-influenza B di cui è rivestita la membrana di nitrocellulosa. Se il campione contiene antigeni SARS-CoV-2, dell'influenza A e dell'influenza B, verrà visualizzata una linea colorata nella regione della linea del test corrispondente (linea "A", "B", "S"). Se il campione non contiene antigeni SARS-CoV-2, Influenza A e Influenza B, non comparirà alcuna linea colorata nell'area della linea del test, ad indicare un esito negativo. Con la funzione di controllo procedurale, compare sempre una linea colorata (linea “C”) nella regione della linea di controllo, a indicare che è stato aggiunto il volume di campione corretto e che la migrazione lungo la membrana è avvenuta regolarmente.
COMPONENTI PRINCIPALI
I seguenti componenti sono inclusi nel kit per test rapido antigene SARS-CoV-2, Influenza A e Influenza B:
1. Test a cassetta.
2. Provetta di estrazione (con soluzione di estrazione).
3. Tampone.
4. Istruzioni per l’uso.
Nota: In base alle specifiche della confezione del prodotto, ogni test è dotato di 1 test a cassetta, 1 provetta di estrazione (con soluzione di estrazione), 1 tampone, inoltre, ciascuna confezione è dotata di 1 foglietto di istruzioni per l'uso. Materiali necessari ma non in dotazione:
1. Orologio, timer o cronometro.
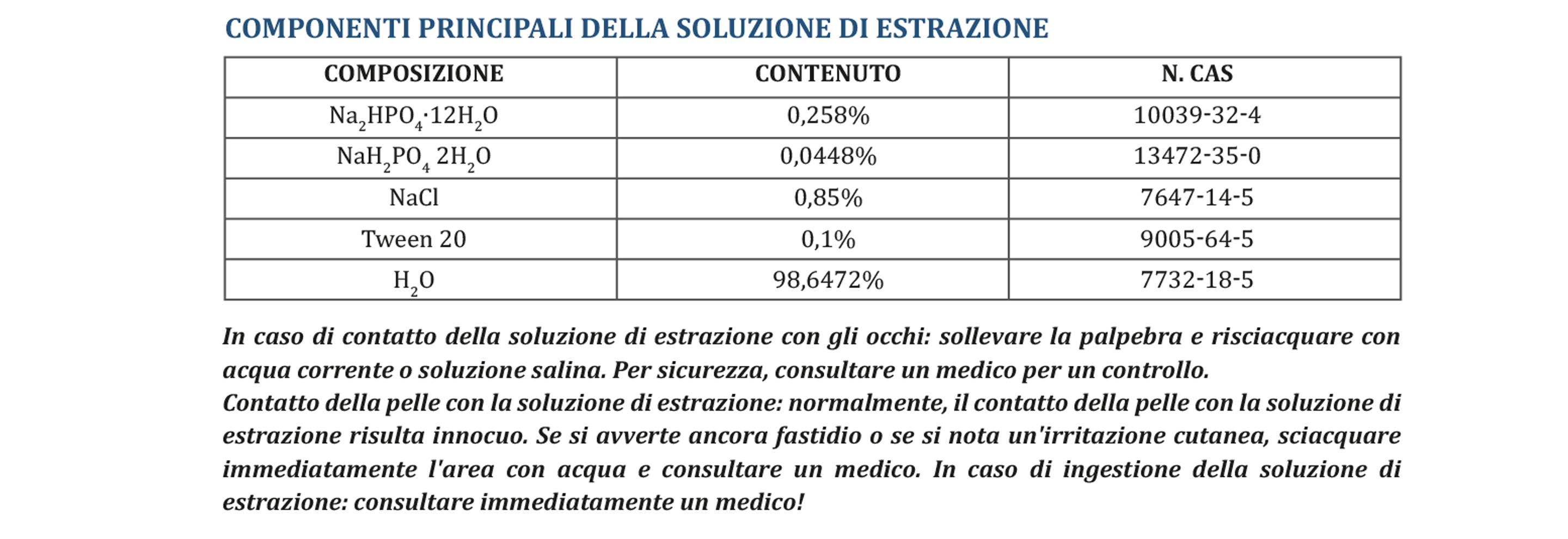
In caso di contatto della soluzione di estrazione con gli occhi: sollevare la palpebra e risciacquare con acqua corrente o soluzione salina. Per sicurezza, consultare un medico per un controllo. Contatto della pelle con la soluzione di estrazione: normalmente, il contatto della pelle con la soluzione di estrazione risulta innocuo. Se si avverte ancora fastidio o se si nota un'irritazione cutanea, sciacquare immediatamente l'area con acqua e consultare un medico. In caso di ingestione della soluzione di estrazione: consultare immediatamente un medico!
CONDIZIONI DI CONSERVAZIONE E SCADENZA
1. Conservare il prodotto a una temperatura compresa tra 2 e 30° C, la scadenza è 24 mesi.
2. La scheda per test dovrebbe essere utilizzata immediatamente dopo l'apertura della busta.
3. I componenti del test, quando vengono usati, dovrebbero trovarsi a temperatura ambiente (15 - 30° C).
AVVERTENZE E PRECAUZIONI
1. Per uso diagnostico in vitro.
2. Questo test è stato autorizzato solo per il rilevamento di proteine da SARS-CoV-2, Influenza A/B non per qualsiasi altro virus o agenti patogeni.
3. Non utilizzare questo kit oltre la data di scadenza stampata sul cartone esterno.
4. Gli esiti del test devono essere determinati visivamente.
5. Le prestazioni del test dipendono dalla qualità del campione ottenuto, nonché dalla manipolazione e dal trasporto del campione stesso. Esiti non corretti possono derivare da prelievo e/o manipolazione inadeguati dei campioni. Data l’importanza della qualità dei campioni, si consiglia formazione nel loro prelievo. Seguire le linee guida di sicurezza della clinica e/o del laboratorio nelle fasi di prelievo, manipolazione, conservazione e smaltimento dei campioni dei pazienti e di tutti gli oggetti esposti ai campioni dei pazienti.
6. Non riutilizzare alcun componente del kit.
7. Prelievo, conservazione e trasporto appropriati del campione sono di importanza fondamentale per le prestazioni del test.
8. Smaltire i kit per test utilizzati come normali rifiuti domestici, nel rispetto dei requisiti locali.
9. Dopo la ricerca, la soluzione di estrazione contiene lo 0,1% di Tween 20, che ha un buon effetto di inattivazione del virus.
10. Sebbene la soluzione di estrazione di questo prodotto abbia l'effetto di inattivare il virus, si consiglia comunque di smaltire tutti i componenti del kit come indicato dalle Linee guida dei requisiti normativi locali o delle autorità di regolamentazione.
11. Bambini e adolescenti di età inferiore a 18 anni o persone che non sono in grado di capire correttamente le istruzioni dovrebbero effettuare il test sotto la supervisione di un adulto o di qualcuno in grado di comprendere correttamente le istruzioni.
CARATTERISTICHE DELLE PRESTAZIONI
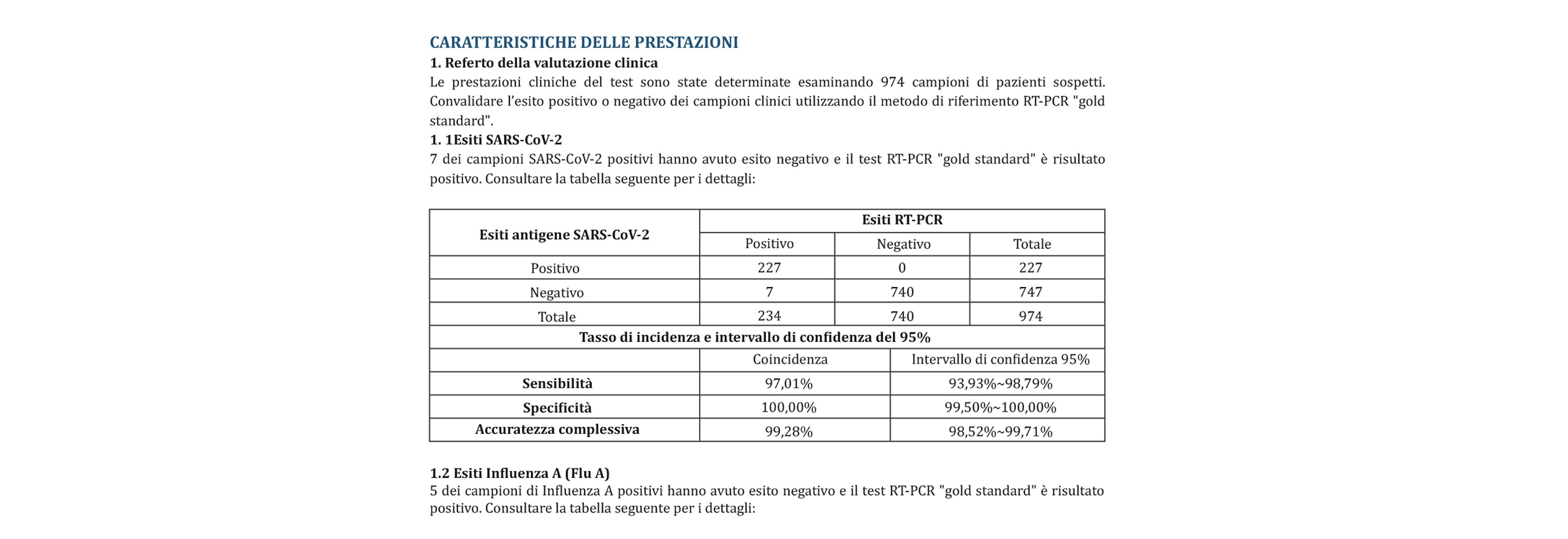
1. Referto della valutazione clinica
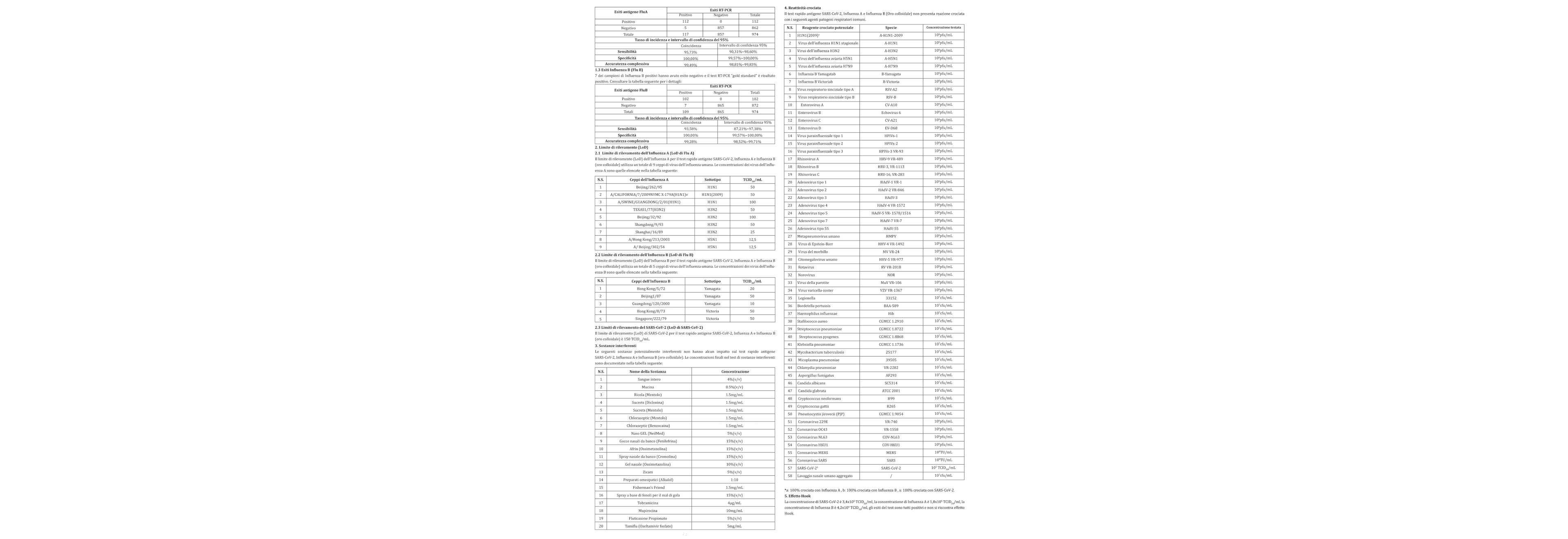
Le prestazioni cliniche del test sono state determinate esaminando 974 campioni di pazienti sospetti. Convalidare l’esito positivo o negativo dei campioni clinici utilizzando il metodo di riferimento RT-PCR "gold standard".
1. 1Esiti SARS-CoV-2
7 dei campioni SARS-CoV-2 positivi hanno avuto esito negativo e il test RT-PCR "gold standard" è risultato positivo. Consultare la tabella seguente per i dettagli:
STUDIO DI USABILITÀ
Sunybio ha condotto uno studio per valutare se un utente che effettua un autoesame è in grado di seguire le istruzioni ed eseguire correttamente le fasi del test per il test rapido antigene SARS-CoV-2, Influenza A e Influenza B (oro colloidale), compresi il prelievo del tampone nasale e l’interpretazione corretta degli esiti.
Sono stati invitati 193 volontari a partecipare alla prova. I volontari dovevano utilizzare il Dispositivo e completare il test in base all'autoapprendimento delle istruzioni per l’uso senza alcuna guida professionale e erano tenuti anche a compilare i questionari per l’utente per valutare oggettivamente l'uso del prodotto. Dopo l'analisi, il livello di istruzione dei 193 utenti non professionisti medici partecipanti variava da Nessuno a College o superiore. L'intervallo d’età era compreso tra 18 e 80 anni. Tutti i partecipanti non avevano né esperienza in test di laboratorio, né nel settore medico né formazione specifica di laboratorio. La lettura dell’esito da parte degli utenti non professionisti è del tutto coerente con quella degli utenti professionisti. Confronto tra RT-PCR in tempo reale e kit: la sensibilità al SARS-CoV-2 è pari al 97,37% e la specificità è del 100%, la sensibilità all'influenza A è pari al 94,29% e la specificità è del 100%, la sensibilità all'influenza B è pari al 94,29% e la specificità è del 100%. Dall’esito del test si evince che l'applicazione del kit è stata considerata di facile esecuzione da tutti gli utenti (100%), nessuno ha affermato di aver avuto difficoltà nell'eseguire il test mediante il kit. Tutti gli utenti hanno ritenuto di poter eseguire e interpretare il test senza l'aiuto di professionisti. In conclusione, le prestazioni di usabilità del kit sono state convalidate.
LIMITAZIONI DEL TEST
1. Gli utenti devono testare i campioni il più rapidamente possibile dopo il loro prelievo.
2. Esiti positivi del test non escludono co-infezioni con altri agenti patogeni.
3. Gli esiti del test dovrebbero essere correlati con l’anamnesi, i dati epidemiologici e gli altri dati a disposizione del medico che valuta il paziente.
4. Un esito falso negativo del test può verificarsi se il livello dell’antigene virale in un campione è inferiore al limite di rilevazione del test oppure se il campione è stato prelevato o trasportato in maniera impropria; pertanto, un esito negativo del test non esclude la possibilità di infezione da Influenza A/B o SARS-CoV-2.
5. Un’esecuzione non corretta della procedura di test potrebbe avere un impatto avverso sulle prestazioni del test e/o invalidare l’esito dello stesso.
6. I contenuti di questo kit devono essere utilizzati per il rilevamento qualitativo di antigeni SARS-CoV-2 e Influenza A/B da campioni prelevati mediante tampone nasale.
7. Il reagente è in grado di rilevare antigene sia vitale che non vitale. Le prestazioni del rilevamento dipendono dal carico di antigene e potrebbero non essere correlate con altri metodi di diagnosi effettuati sullo stesso campione.
8. Esiti negativi del test non sono destinati a indicare la presenza di altre infezioni virali o batteriche diverse da SARS-CoV-2 e/o Influenza A/B.
9. I valori predittivi positivi e negativi dipendono perlopiù dai tassi di prevalenza. È più probabile che esiti positivi rappresentino un falso positivo in periodi di ridotta/nessuna attività della malattia, quando la prevalenza della malattia è bassa. Esiti falsi negativi sono più probabili quando la prevalenza della malattia è elevata.
10. Il presente dispositivo è stato valutato per l’uso esclusivamente con campioni di materiale umano.
11. Il kit è stato convalidato con i tamponi assortiti. L’utilizzo di tamponi diversi potrebbe avere come risultato degli esiti falsi negativi.
CONTROLLO QUALITÀ
Controlli procedurali interni sono inclusi nel test. Una banda colorata che compare nella regione della Linea di controllo (linea “C”) costituisce un controllo procedurale interno. Conferma che è stata aggiunto un volume sufficiente di campione e che è stata seguita la procedura corretta.


Altri prodotti
Sullo stesso tema leggi anche